Navigation des services
Recherche

Pour imaginer une Terre où l'alcool remplacerait l'eau, il va nous falloir faire preuve de beaucoup d'imagination, et commencer par se mettre d'accord sur un point essentiel : l'homme est apparu quand même, malgré le fait que c'eût été impossible dans la réalité.
Une des premières propriétés de l'alcool est d'être hautement inflammable. De ce fait - comme des coeurs amoureux - des océans d'alcool s'enflammeraient au premier coup de foudre, faisant basculer notre planète dans le dernier cercle de l'enfer de Dante. D'autre part, la combustion de l'alcool - comme toutes les combustions du reste - consommerait tant d'oxygène que nous manquerions rapidement d'air, au sens le plus littéral du terme.
Notre petite molécule d'eau a tout d'une grande
La raison pour laquelle l'alcool (éthanol) a été choisi comme substitut de l'eau dans cet article est que le point d'ébullition de l'alcool, qui est de 78 degrés, est relativement proche de celui de l'eau. Dans un monde aux températures ambiantes habituelles, des océans et des pluies d'alcool pourraient donc exister. D'autres substances telles que le méthane (présent par exemple sur Titan, une des lunes de Saturne) ou le dioxyde de soufre (présent sur Vénus) seraient de fait beaucoup plus réalistes que l'alcool, mais ces substances bouillonnent déjà à des températures beaucoup plus basses que l'eau. Un monde dans lequel ces substances seraient à l'état liquide serait donc pour nous un enfer glacé.
A vrai dire, le point d'ébullition de l'eau est étonnamment élevé. En effet, la règle générale est la suivante : plus une molécule est petite et légère, plus son point d'ébullition est bas. Or l'eau (H2O) est une molécule petite et légère ; une molécule d'eau est même moins lourde que les molécules les plus courantes de notre atmosphère composées d'oxygène et d'azote. On pourrait donc logiquement s'attendre à ce que l'eau ait un point d'ébullition bas ; or il est au contraire très élevé, soit 100 °C. Cette propriété si particulière saute aux yeux si l'on compare la molécule d'eau à son alter ego, la molécule de sulfure d'hydrogène, composée d'un atome de soufre (au lieu de l'atome d'oxygène de l'eau) et de deux atomes d'hydrogène (H2S). Cette molécule, pourtant deux fois plus lourde que l'eau, bout déjà à -61 °C.
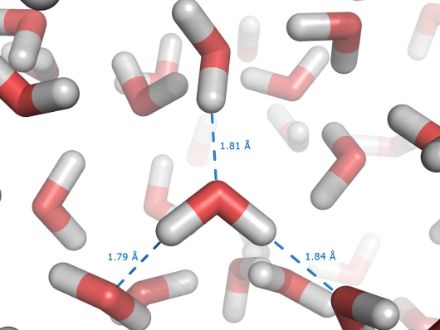
Les molécules d'eau se serrent les coudes
Le point d'ébullition élevé de l'eau s'explique par une très grande "solidarité" des molécules d'eau. Fortement polarisées, ces molécules se tiennent par la main comme autant d'aimants, plusieurs d'entre elles formant ainsi comme une "super molécule".
Les effets de l'alcool ne seraient pas ceux qu'on imagine
L'eau agit comme un véritable accumulateur thermique ; aucune autre substance courante ne peut emmagasiner autant d'énergie thermique par kilo que notre eau. De fait, si l'on refroidit simultanément de 1 °C un kilo d'eau et un kilo d'alcool, l'eau dégagera presque deux fois plus de chaleur que l'alcool.
Sur une Terre d'alcool, cela serait une très mauvaise nouvelle pour l'Europe. Un Gulfstream d'alcool réchaufferait en effet nettement moins notre continent qu'un Gulfstream composé d'eau. Mais pour l'Europe, il y aurait pire encore.
Un froid durable s'installerait en Europe

Une autre propriété caractéristique de l'eau est que sa forme solide (glace) est plus légère que sa forme liquide. Là encore, ce n'est pas le cas de la plupart des autres substances, y compris l'alcool. Sur une Terre d'alcool, cela réjouirait probablement les navigateurs peu au fait des lois de la physique, car les mers polaires resteraient initialement libres de glace, même en hiver. Pouquoi ? De la glace se formant sur une mer d'alcool serait plus lourde que l'alcool liquide et coulerait donc irrémédiablement vers le fond. Cependant, hiver après hiver, et la glace s'accumulant au fond de l'océan, la couche de glace deviendrait progressivement si épaisse qu'elle atteindrait la surface après quelques siècles (ou millénaires...).
Au plus tard à ce moment-là, toute navigation deviendrait impossible. D'autre part, les glaciers sous-marins entraveraint désormais aussi la circulation atmosphérique, et donc le Gulf Stream s'arrêterait. L'Europe se refroidirait inexorablement...
Une Europe tempétueuse, mais sans orages.
Les courants marins froids étant paralysés, la différence de température entre les pôles et les régions tropicales s'accroîtrait, entraînant par là même des tempêtes de plus en plus violentes aux latitudes tempérées. Sur une Terre d'alcool, l'Europe serait donc un continent froid et tempétueux.

Les orages tirent leur énergie de l'énorme quantité de chaleur libérée lorsque la vapeur d'eau se condense (dégagement de chaleur latente). A l'inverse, lorsqu'un kilo d'alcool se condense, seul un tiers de l'énergie est libérée par rapport à la même quantité d'eau.
Partons du principe que la quantité de vapeur d'alcool dans l'atmosphère serait similaire à celle de la vapeur d'eau. Dans ce cas, les orages ne bénéficieraient que du tiers de l'apport d'énergie qu'ils tirent de la condensation de la vapeur d'eau et seraient de ce fait nettement plus timides. Il en irait d'ailleurs de même pour les cyclones tropicaux, qui fonctionnent de manière similaire. Dans ce cas cependant, et comme nous venons de le voir, des océans d'alcool sous les tropiques seraient plus chauds, ce qui entraînerait une évaporation plus importante d'alcool, compensant dans une certaine mesure le déficit énergétique associé au dégagement de chaleur latente.
A tout Seigneur tout honneur

Il y aurait encore beaucoup à dire sur l'eau et ses propriétés, lesquelles font d'elle une substance absolument unique et source de vie sur Terre.
Puisse cet article avoir suscité votre intérêt, et vous donner envie d'en apprendre davantage par vous-même.