Navigation des services
Recherche
Quelques concepts de base pour commencer
Tout gaz exerce une certaine pression sur son environnement, et cette pression dépend essentiellement de la température dudit gaz (pour un volume donné, qui lui ne change pas) ; par exemple en été, la pression dans les pneus d’une voiture augmente lorsqu’il fait très chaud. La vapeur d’eau étant un gaz, elle ne fait pas exception à cette règle : plus elle est chaude, plus la pression qu’elle exerce est élevée. La vapeur d’eau représente une toute petite partie de la masse gazeuse de l’atmosphère (de 0.1 à 5 % selon les régions), c’est pourquoi l’on parle de « pression partielle de vapeur d’eau » pour évoquer sa contribution à la pression totale en un lieu donné ; cette pression partielle est donc très variable d’un lieu à l’autre.
À une température donnée, la quantité d’eau maximale qu’une parcelle d’air peut contenir sous forme de vapeur est fixe ; la pression de vapeur correspondant à ce maximal est appelée « pression de vapeur saturante ». Il s’agit d’un point d’équilibre dynamique, où le nombre de molécules d’eau qui s’échappe de la surface sous forme de gaz est égal au nombre de molécules d’eau qui réintègre le liquide à partir de l’atmosphère ; la pression de vapeur saturante est donc intimement liée à la température du liquide. Lorsque la pression partielle de vapeur d’eau est égale à la pression de vapeur saturante, la masse d’air est à 100 % d’humidité.
Un liquide entre en ébullition lorsque sa pression de vapeur saturante est équivalente à la pression totale extérieure au liquide. Pour faire bouillir de l’eau, il y a donc deux possibilités : augmenter sa température ou diminuer la pression du récipient dans lequel elle est contenue. A l’air libre, l’eau entre en ébullition lorsque la pression de vapeur saturante est égale à celle de la pression atmosphérique. C’est ce point, à la pression atmosphérique standard au niveau de la mer (1013 hPa), qui a été choisi par Anders Celsius en 1742 pour fixer le degré 100 de son échelle de température centigrade.
Plus concrètement
Puisque la pression de vapeur saturante est directement reliée à la température du liquide, plus la température est élevée, plus la pression de vapeur l’est également. Par conséquent, tout changement de pression atmosphérique change la températures d’ébullition de l’eau : une augmentation de la pression atmosphérique augmente cette température, alors qu’une diminution de la pression atmosphérique l’abaisse.
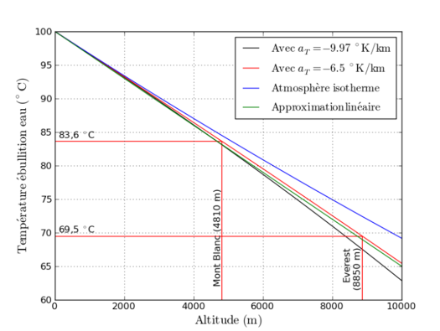
La figure 1 montre que pour faire bouillir de l’eau au niveau de la mer, il faut la chauffer à 100°C ; vers 1500 m sur les crêtes du Jura ou la pression atmosphérique avoisine les 850 hPa, l’eau bout à 95°C environ. Au sommet du Mt-Blanc (500 hPa environ), l’eau bout à 84°C environ et à 70°C seulement au sommet de l’Everest.
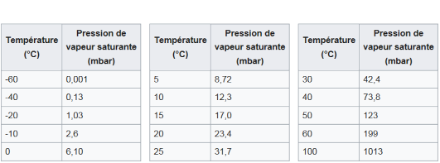
La figure 2 montre qu’à 100°C, la pression de vapeur saturante est égale à la pression atmosphérique standard au niveau de la mer (1013 hPa). Il ressort également de ce tableau qu’il est possible de faire bouillir de l’eau à température ambiante (environ 15°C) si l’on abaisse la pression atmosphérique à environ 17 hPa, ce qui représente en atmosphère libre une altitude de plus de 20'000 m ! Cette expérience est fréquemment effectuée dans les laboratoires de physique des gymnases et collèges en faisant bouillir de l’eau sous une cloche dont on diminue la pression.
Une fois que l’eau bout, sa température demeure constante, même si on maintient l’eau sur une source d’énergie. En effet, l’apport d’énergie supplémentaire n’est pas utilisé pour chauffer l’eau, mais pour lui faire opérer un changement de la phase liquide à la phase gazeuse, ce qui nécessite énormément d’énergie.
Ainsi, pour cuire des aliments en haute montagne, il faudra beaucoup plus de temps qu’en plaine dans la mesure où il ne sera pas possible de chauffer de l’eau au-dessus de son point d’ébullition, lequel peut être nettement inférieur à ce qu’il est au niveau de la mer. On a vu en effet à la figure 1 qu’au sommet de l’Everest, il n’est pas possible de chauffer de l’eau au-delà de 70°. L'autre solution est d'emporter une cocotte minute (marmite à vapeur), laquelle permettra de faire monter la pression interne.
A 20'000 m en atmosphère libre, il ne serait pas possible de faire cuire des aliments puisque la température de l’eau ne pourrait pas monter au-dessus de 15 °C,… mais elle serait quand même « bouillante » !
Comme dirait M. Cyclopède, alias Pierre Desproges : « c’est étonnant non ? ».
Pour conclure, une expérience intéressante peut être visualisée ici
Bonne semaine à tous !