Navigation des services
Recherche
La première de ces couches, celle qui touche le sol, s’appelle la « troposphère ». Sous nos latitudes, elle n’excède pas 20 km de hauteur mais – la densité de l’air diminuant très rapidement avec l’altitude – concentre en son sein 80 % de la masse totale de l’atmosphère. La première « croûte » séparant la troposphère de sa voisine, la stratosphère, s’appelle la « tropopause », zone de température constante de quelques kilomètres d’épaisseur. C’est dans la troposphère que se produisent la totalité des phénomènes météorologiques : perturbations, transfert de chaleur latente des tropiques vers les pôles, alizés, et même ouragans, médicanes, etc…, rien de tout cela ne peut grimper au-dessus de la tropopause. Les courants ascendants des plus puissants orages parviennent avec beaucoup d’élan à percer brièvement ce couvercle, avant d’être sèchement rappelés à l’ordre ; on appelle cela l’ « overshooting top » :

Stratosphère et couche d'ozone
Depuis le sol jusqu’à la tropopause, la température décroît en moyenne d’environ 0.6°C par 100 m d’altitude. A l’inverse, dans la stratosphère (entre 20 et 40 km d’altitude environ), la température augmente avec l’altitude, ce qui est apparemment contraire à la loi des gaz parfaits qui voudrait que – à volume constant – la température diminue lorsque la pression baisse. D’où vient donc cette hausse des températures semblant défier les lois de la physique ?
Il convient ici de présenter les principaux acteurs de notre histoire, laquelle expliquera cette apparente anomalie :
Ce que nous appelons « air » est un mélange de différents gaz. Le principal d’entre eux est l’azote, qui se taille la part du lion avec 80 % de l’atmosphère, mais qui restera absent de l’histoire. Vient ensuite un des acteurs principaux : l’oxygène, avec 19 % de l’atmosphère. Tout le reste, vapeur d’eau, CO2, pollution, etc… représente environ 1 % du total.
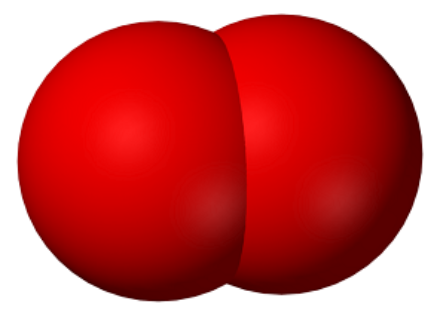
L’oxygène – qui est un des éléments (atomes) du tableau périodique de Mendeleïev (qui nous a tant fait souffrir au collège !) – est présent dans l’atmosphère sous la forme d’une molécule simple, elle aussi appelée « oxygène » (dioxygène pour les puristes), et comportant 2 atomes. La voici :
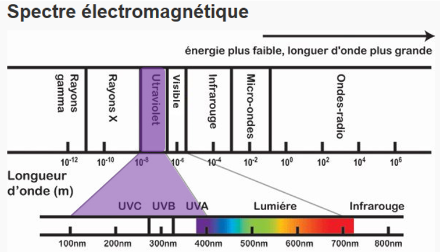
L’autre acteur principal de l’histoire se nomme « rayonnement ultraviolet », UV pour les intimes. Dans la grande famille du rayonnement émis par le soleil, que l’on appelle le « spectre solaire », il fait partie des enfants terribles, entendez par là qu’il est d’une énergie débordante ; de fait, seuls les rayons X (votre radiologue) et les rayons Gamma (radioactivité) sont plus énergétiques. L’énergie qu’il porte est telle qu’elle peut être sérieusement dommageable pour tous les êtres vivants.
Et maintenant, voici l’histoire de la rencontre entre nos deux acteurs principaux !
Lorsque le rayonnement ultraviolet en provenance du soleil rencontre une molécule d’oxygène, il ne fait pas dans la dentelle, il la casse en deux ! L’énergie qu’il a utilisée pour séparer ces deux amoureux est cependant perdue pour lui, et c’est tant mieux pour la vie sur Terre. Nous avons donc maintenant deux atomes d’oxygènes isolés et très malheureux (en chimie, on dit « instables » car ils tendent à se recombiner urgemment avec d’autres atomes). Ces atomes isolés vont donc rapidement s’unir à la première molécule qui les acceptera, en l’occurrence une autre molécule d’oxygène diatomique. Ce faisant, ils vont former une molécule d’oxygène comportant 3 atomes (triatomique) appelée l’ozone.
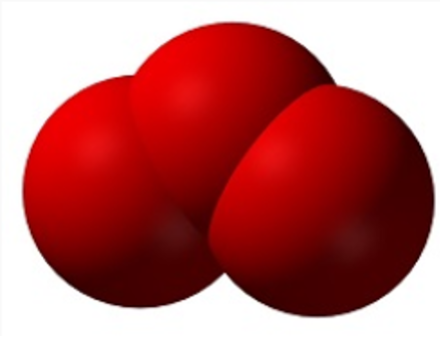
Comme la plupart des ménages à trois, celui-ci n’est pas très stable non plus. Heureusement du reste, car sinon la proportion d’ozone tendrait à augmenter indéfiniment dans l’atmosphère, ce qui n’est pas le cas. En réalité, trois processus contribuent également à détruire l’ozone. Deux sont naturels et un ne l’est pas :
- Une partie de l’ozone est détruite par le rayonnement UV, sur le même modèle que précédemment.
- Un atome d’oxygène quitte spontanément la molécule d’ozone pour s’accoquiner avec un autre atome d’oxygène « célibataire » ; c’est le seul processus actif durant la nuit (donc en l’absence de rayonnement UV).
- Des composés chlorés artificiels détruisent également l’ozone.
Au final, l’équilibre entre production et destruction de l’ozone stratosphérique est chose délicate et fragile ; les fameux et dangereux « trous d’ozone » résultent précisément d’une rupture de cet équilibre.
Pour en revenir à notre mille-feuilles atmosphérique, on comprend maintenant que le réchauffement de la stratosphère au fur et à mesure que l’on s’élève est dû pour une grande part à l’absorption par la couche d’ozone de l’énergie du rayonnement ultra-violet.
Le « mauvais » ozone
Sans cette couche d’ozone stratosphérique, la vie sur Terre serait détruite par le rayonnement ultraviolent en provenance du soleil ; merci donc à elle ! Cependant, l’ozone est également présent dans la troposphère, et là il est nettement moins bienvenu. En effet, durant l’été, lorsque le soleil est haut sur l’horizon (et que la portion d’atmosphère traversée est donc plus mince), une partie du rayonnement ultraviolet parvient jusqu’à basse altitude. Il en profite bien sûr pour endommager notre peau, mais ne se contente pas de ce méfait. Il casse également d’autres molécules contenant de l’oxygène, en particulier les dioxydes d’azotes (NO2) produits par les gaz d’échappement des voitures. L’atome d’oxygène ainsi libéré se combine, comme dans la stratosphère, avec un molécule d’oxygène pour former de l’ozone. Malheureusement, lorsqu’on l’inhale en fortes concentrations, l’ozone est un gaz toxique très oxydant, irritant les muqueuses et pouvant aller jusqu’à provoquer des crises d’asthme ou des œdèmes pulmonaires. D’où la nécessité de limiter absolument les émissions de polluants, en particulier lors des canicules estivales.
L’ozone est donc un ami qui vous veut du bien… mais dont il faut quand même se méfier. Dans la partie « sport et santé » de l’App MétéoSuisse, l’ozone troposphérique fait partie des polluants dont les relevés, transmis par les autorités cantonales, peuvent être visualisées. Le rayonnement UV y est également disponible sur une échelle de 1 à 11, flanqué des mesures à prendre pour s’en protéger.
La Suisse possède une très longue tradition de mesure de l’ozone dans l’atmosphère, puisque celle-ci a commencé en 1926 à Arosa. Davantage de détails à la page suivante de notre site Internet :
Article de l'Organisation Météorologique Mondiale (OMM) concernant l'évolution positive de la couche d'ozone :